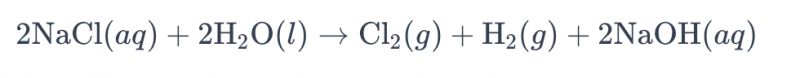Процес електролизе раствора соли коришћењем титанијумских електрода за производњу хлора се обично назива „електролиза раствора соли“. У овом процесу, титанијумске електроде се користе за олакшавање реакције оксидације хлоридних јона у раствору соли, што доводи до стварања гасовитог хлора. Укупна хемијска једначина реакције је следећа:
У овој једначини, хлоридни јони се оксидују на аноди, што резултира производњом хлора, док се молекули воде редукују на катоди, дајући водоник. Поред тога, хидроксидни јони се редукују на аноди, формирајући водоник и натријум хидроксид.
Избор титанијумских електрода је због одличне отпорности на корозију и проводљивости титанијума, што му омогућава да стабилно пролази кроз реакцију током електролизе без корозије. Због тога су титанијумске електроде идеалан избор за електролизу слане воде.
Електролиза слане воде обично захтева спољни извор напајања који обезбеђује енергију за електролитичку реакцију. Овај извор напајања је обично једносмерна струја (DC) јер електролитичке реакције захтевају константан смер протока струје, а једносмерна струја може да обезбеди константан смер струје.
У процесу електролизе слане воде за добијање хлорног гаса, обично се користи нисконапонски једносмерни извор напајања. Напон извора напајања зависи од специфичних реакционих услова и дизајна опреме, али се генерално креће између 2 и 4 волта. Поред тога, јачина струје извора напајања је кључни параметар који треба одредити на основу величине реакционе коморе и жељеног приноса производње.
Укратко, избор напајања за електролизу слане воде зависи од специфичних захтева експеримената или индустријских процеса како би се осигурала ефикасна реакција и добијање жељених производа.
Време објаве: 16. јануар 2024.